

2023年3月7日,香港中文大学(深圳)医学院叶德全、杜洋和竺立哲课题组合作于国际知名科学期刊-《美国国家科学院院刊》(Proceedings of the National Academy of the Sciences, PNAS)在线发表了题为“Cryo-EM structure of the human chemerin receptor 1–Gi protein complex bound to the C-terminal nonapeptide of chemerin”的研究论文。叶德全教授和杜洋教授为本文共同通讯作者,香港中文大学(深圳)医学院/科比尔卡创新药物开发研究院作为第一单位,王畯霖博士、陈耕博士、廖绮文博士为本文共同第一作者,吕闻凭博士、刘爱军博士参与了本项研究。竺立哲课题组作为共同作者,参与了分子动力学模拟相关工作。科比尔卡冷冻电镜中心为CMKLR1蛋白质复合物的结构解析提供了硬件设施和服务。该项研究利用冷冻电镜解析了与 Chemerin (趋化素)蛋白羧基端活性肽段结合的趋化素受体1(CMKLR1)-G蛋白复合物的三维结构,揭示了趋化素结合及受体活化的分子机制。

趋化素是经蛋白酶水解后形成的具有趋化作用的小蛋白,全长157个氨基酸。除引起树突状细胞等免疫细胞趋化迁移外,趋化素还对脂肪细胞生成起到重要作用,是一种脂肪因子。CMKLR1是趋化素的主要作用受体,属于人G蛋白偶联受体(GPCR)家族,具有七次跨膜α螺旋的结构特征。CMKLR1与全长趋化素或者其羧基端活性9肽(C9)结合后,产生跨膜信号。本研究利用这一特性解析了与C9结合的CMKLR1-Gi蛋白质复合物结构,首次报道了CMKLR1激活态的三维结构(图1)。
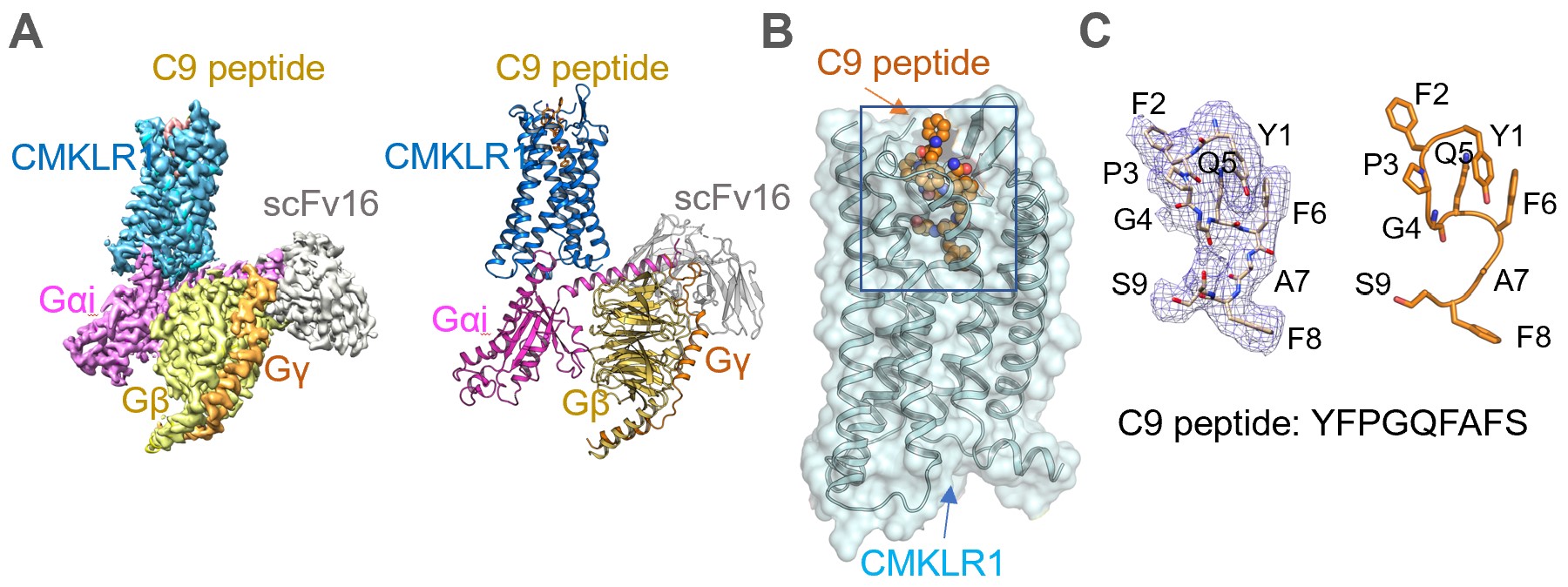
图1.趋化素受体1与配体C9肽及Gi蛋白复合物的冷冻电镜结构。A. 三维密度图及原子模型,scFv16为稳定胞内G蛋白构像的抗体。B. 配体C9肽在趋化素受体1上的结合口袋位置(蓝框)。C. 配体C9肽在结合口袋中的“S”形构象。
本项研究显示,趋化素在CMKLR1上的结合口袋和结合模式与广为存在于免疫系统的趋化因子(chemokines)及受体相比,具有很大的不同。趋化素羧基端活性9肽C9插入结合口袋较深,在口袋中呈现“S”型,其第8个氨基酸(F8)接近触发G蛋白活化的“拨动开关”(“toggle switch” W2736.48),可解释C9肽激活受体的现象。室温下5次独立的1μs全原子分子动力学模拟证明了Cryo-EM捕获的CMKLR1-C9界面在热力学扰动下保持稳定,并发现了配体Y1和受体E2836.58之间的氢键作用。与其相反,已知趋化因子与GPCR 结合更多地利用较为表浅而接触面广的受体胞外段结构(图2)。此外,趋化素与CMKLR1的结合不需要甲酰基识别,因此有别于携带N端甲酰基的趋化短肽与FPR受体结合的模式。这说明趋化素结合代表了另一种激活具有趋化功能GPCR的机制。通过结构解析发现,趋化素的结合模式与血管紧张素II受体的结合模式非常相似,为进一步探讨CMKLR1的生理病理功能提供了线索。
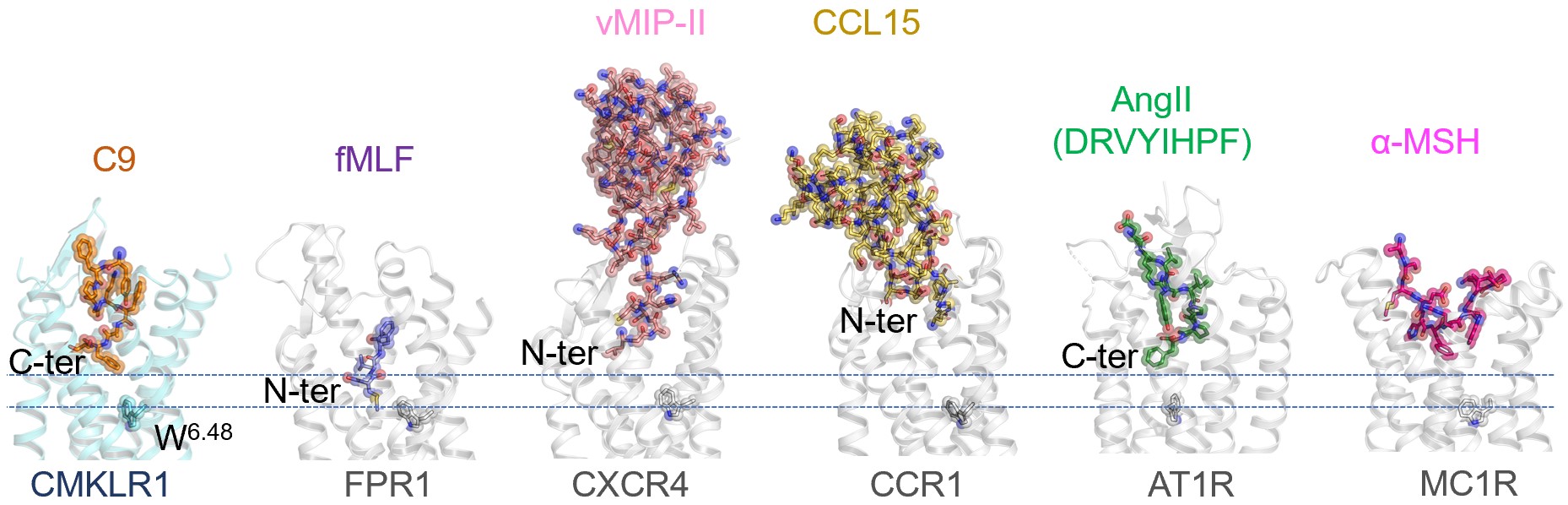
图2. 趋化素羧基端活性肽C9结合趋化素受体1 (CMKLR1) 模式与其它受体结合模式对比。自左至右:趋化素受体1 CMKLR1 + C9,甲酰肽受体1 FPR1 + 甲酰三肽fMLF,趋化因子受体 CXCR4 + vMIP-II,趋化因子受体 CCR1 + CCL15,血管紧张素受体 AT1R + 血管紧张素II,黑素皮质素受体1 MC1R + α-黑色素细胞刺激素 α-MSH。两条平行的虚线之间为跨膜段的大致位置,胞外域在上方。
综上所述,CMKLR1-C9复合物结构的解析为A类GPCR结合多肽和小蛋白质配体提供了信息和参考,也为相关靶点的药物开发提供了帮助;异于其他趋化素受体“二位点二步骤”的结合模式为进一步解明趋化素受体激活机制翻开了新的一页;和血管紧张素II结合AT1受体相似的“S”型姿势为趋化素和其活性多肽调控血管收缩及肥胖相关的代谢紊乱提供了结构基础。
原文链接:
Wang J, Chen G, Liao Q, Lv W, Liu A, Zhu L, Yang D, Ye, R.D. (2023) Cryo-EM structure of the human chemerin receptor 1–Gi protein complex bound to the C-terminal nonapeptide of chemerin. Proc. Natl. Acad. Sci. U.S.A., https://www.pnas.org/doi/10.1073/pnas.2214324120
教授介绍

叶德全 校长讲座教授
医学院副院长(科研与创新)
叶德全教授1982年本科毕业于上海第二医学院,并于1988年获美国圣路易斯华盛顿大学博士学位。自1989年起先后在Scripps研究所及伊利诺伊大学医学院担任助理教授、副教授、教授,其科研项目获美国国立健康研究院连续资助25年。主要研究方向包括G蛋白偶联受体的信号转导及在固有免疫细胞中的作用,炎症机制和病理模型及相关药物靶标的发现。先后与强生、诺华、GSK等公司开展研发合作,作为第一发明人获批美国专利2项、中国专利1项,共同发明人专利2项。发表SCI学术论文220篇,被引1万多次。于2010年回国担任上海交通大学讲席教授、药学院院长;2015年1月至2019年1月任澳门大学讲座教授。学术兼职包括FASEB Journal副主编,Pharmacological Reviews 副主编,Physiological Reviews副主编, Molecular Pharmacology及British Journal of Pharmacology 编委。

杜洋 助理教授
医学院助理院长(科研与创新)
杜洋教授于中南大学湘雅医学院和中国科学技术大学分别取得学士和博士学位,之后赴美国斯坦福大学医学院分子与细胞生理学系,师从2012年诺贝尔化学奖得主布莱恩·科比尔卡(Brian Kobilka)教授,从事G蛋白偶联受体(GPCR)相关的博士后研究训练,并于2016年底转为斯坦福医学中心研究科学家。期间获授美国心脏协会(American Heart Association)全额博士后奖学金和斯坦福心血管研究所资助等,并获得美国密歇根大学安娜堡分校医学院助理教授职位。主要研究方向是以β2肾上腺素受体等重要药物靶点的GPCR为对象,研究其与下游信号分子复合物的结构、功能和分子药理特性。
杜教授迄今已发表60余篇高质量SCI论文,包括以通讯或第一作者(含共同)在Cell、Science、Nature Comm、Science Advances、Cell Research、JACS等国际一流期刊等报道的科研成果,并受邀为Science、Nature Comm等多种国际主流科学杂志审稿。现为香港中文大学(深圳)医学院助理教授、博士生导师,科比尔卡创新药物开发研究院研究员。杜教授于2021年起作为教育部特聘专家,已入选国家级、广东省和深圳市等各级高层次人才项目,获得深圳市优秀教师、校长模范教学奖和大学青年科研创新奖等荣誉奖励,并主持国自然和深圳市重点等多个科研项目。

竺立哲 助理教授
竺立哲博士毕业于阿姆斯特丹大学化学系,彼时作为玛丽居里初级研究员,通过分子模拟手段研究蛋白质受体别构效应的机理,后于2012年赴香港科技大学从事博士后研究,致力于增强抽样算法同马尔可夫态模型方法的整合。竺教授于2018年8月加入香港中文大学(深圳),现在医学院及瓦谢尔计算生物研究院担任助理教授。
竺博士目前的研究兴趣包括RNA与蛋白质相互作用,RNA/DNA干扰机制,高效自动化路径搜索方法及其他增强采样算法的开发等。竺博士已在国际主流期刊(Physical Review Letters, The Journal of Physical Chemistry Letters, PLOS Computational Biology, Current Opinion in Structural Biology, Journal of Computational Chemistry等)发表论文20篇。
文字&图片:叶德全教授&杜洋教授课题组